氣體的特點是無一定形狀,也無一定體積,氣體能無限地膨脹而完全充滿于任何體積的容器中;氣體又能均勻地混合,數種不同種類的氣體,不管其比例如何都能混合成一均勻狀態。
物質的氣體狀態由壓強、體積和溫度三個因素來決定。當氣體壓縮時,壓強增加,體積縮小,溫度升高;當氣體膨脹時,壓強降低,體積增大,溫度降低。
可以用氣體的基本定律來概括氣體狀態變化的一些規律。
一、波義耳—馬略特定律:一定質量的氣體,在恒溫下,氣體的壓強與其體積的乘積為常數。這定律說明當溫度因素不變時,壓強與體積的關系,可以表示為:
P1V1=P2V2=常數
P1,V1表示變化前氣體的壓強和體積,
P2,V2表示變換后氣體的壓強和體積。
二、蓋·呂薩克定率:一定質量的氣體,在恒壓下,氣體的體積與其絕對溫度成正比。這定律說明當壓力因素不變時,體積與溫度的關系。可以表示為:
V=常數×T
V表示氣體的體積。
T表示絕對溫度,
三、道爾頓定律:不相互起化學作用的混合氣體的總壓強等于各氣體分壓強的總和,這定律表明幾種氣體在一定時的壓強關系,可一表示為:
P=P1+P2+Pn
P表示混合氣體的總壓強。
P1……………Pn表示各氣體的分壓強。
四、阿佛加德羅定律:等體積的任何種類氣體,在同溫度和同壓強下均有相同的分子數。例如每立方厘米的氣體在1大氣壓和20℃的情況下分子數為:2.69×1010個。
氣體的基本定律適用于氣體,對于蒸汽不一定適用。
氣體分子的平均自由程也是氣體分子運動的一個參數,氣體的壓強也可以理解為氣體分子對容器壁碰撞的結果。事實上氣體分子運動不僅碰撞容器壁,而且還發生氣體分子間的互相碰撞。我們把氣體分子二次碰撞間經歷的平均距離叫做氣體分子間的平均自由程。
平均自由程與氣體的濃度、壓強有關,濃度大,壓強大時分子間很容易碰撞,因而平均自由程就小;濃度小,壓強小時分子間比較不容易碰撞,因而平均自由程就大。
在常溫和常壓下,由于空氣分子的平均自由程很小,從液體蒸發出來的分子或從固體升華出來的分子,很容易與氣體分子碰撞而返回到原來液體或固體的表面,因此蒸發和升華的速度很慢。隨著真空度的升高,氣體分子變得越來越稀,分子的平均自由程逐漸增大,于是分子間的碰撞將較少發生,這時液體的蒸發速度和固體的升華速度將迅速增加,大量的分子將會從蒸氣源飛離出來,甚至形成蒸汽流。另外,在真空較高的情況下,由于氣體的分子較少,分子間的碰撞很少發生,所以氣體的對流就不可能形成,因此在真空度較高的情況下,依*對流的熱量傳遞方式將減少甚至消失;依*氣體分子的熱傳導也將減少甚至消失。這時,真空系統內依*固體的熱傳導和輻射仍然存在。
實驗指出,當真空達到幾十微米汞柱數值時,氣體分子的熱傳導和對流可以忽略不計,這時熱量的傳遞依*固體的傳導和輻射進行,而真空度上升到幾百微米汞柱數值時,通過氣體分子的熱傳導和對流立即變得顯著起來。
當氣體在導管內流過時,它總是受到一定的阻礙,在壓強較高時它主要消耗于氣流各層間的內摩擦;在壓強較低時它消耗于氣體分子與四壁的碰撞過程。當管道粗、短、直時則流動的阻礙就較小。
(供稿:駿騰機電/quill))



 壽力授權證書2018
壽力授權證書2018 駿騰機電圖片展示
駿騰機電圖片展示 普旭油潤滑旋片真空泵-R5系列
普旭油潤滑旋片真空泵-R5系列 壽力螺桿真空泵:VS16-40
壽力螺桿真空泵:VS16-40 玻璃加工行業上的案例展示
玻璃加工行業上的案例展示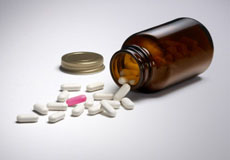 真空泵在制藥行業上的應用
真空泵在制藥行業上的應用 第十八屆SIMM深圳機械展如期而至,駿騰機電赴約前行
第十八屆SIMM深圳機械展如期而至,駿騰機電赴約前行 真空系統安裝要求和注意事項
真空系統安裝要求和注意事項 銘記歷史、緬懷先烈、珍愛和平、開創未來——海騰文化組織觀看抗戰勝利80周年閱兵直播有感
銘記歷史、緬懷先烈、珍愛和平、開創未來——海騰文化組織觀看抗戰勝利80周年閱兵直播有感 勠力同心 砥礪前行 駿騰機電參加壽力經銷商培訓會議
勠力同心 砥礪前行 駿騰機電參加壽力經銷商培訓會議 深圳駿騰機電總部聯系方式
深圳駿騰機電總部聯系方式 深圳駿騰機電:成都辦事處聯系方式
深圳駿騰機電:成都辦事處聯系方式
